近年来,随着国内创新药行业的蓬勃发展,国内创新药领域创新成果频出,越来越多的国内创新药企业在国际舞台发出自己的声音,国际主流学术会议成为国内创新药企业发布最新临床数据的主要选择。
在当前国内创新药企研发管线主要聚焦在肿瘤治疗领域的大背景下,肿瘤领域的重要学术会议成为国内创新药企业展示自身研发实力的重要平台,关注研究相关学术会议的最新临床进展对创新药领域的研究具有重要意义。
在全球范围内,每年约有二十余场肿瘤治疗领域的国际性学术会议召开。其中,美国临床肿瘤学会(ASCO)是目前世界上规模最大、学术水平最高、最具权威的临床肿瘤学会议,汇聚了全球临床肿瘤学研究的精英,被公认为全球最重要的肿瘤学术会议。
通常而言,ASCO将自有投稿的摘要交流等级分为5类,从重要性往下排列依次为:口头报告、壁报讨论、壁报展示、摘要收录和拒稿。其中,口头报告又包括了LBA(Late Breaking Abstract)项目,即极具新颖性和创新性,研究结果可能会引起一定轰动性,需要事先保密的项目。
近期,2024年ASCO年会在芝加哥以线上和线下相结合的形式展开。在本届ASCO年会上,信达生物首次披露了CLDN18.2/CD3双抗IBI389胰腺癌、胃癌的数据,相关研究以口头报告形式发布。
其中,胰腺癌入选标准治疗失败或不耐受的局部晚期、难治性或转移性胰腺癌患者。截至2024年1月9日,共有64例CLDN18.2阳性胰腺癌患者入组,所有患者既往均接受过治疗,中位治疗线数为2。在23例可评价患者中,7例患者PR(部分缓解),9例患者SD(疾病稳定),对应ORR为30.4%,DCR为69.6%,尚未达到中位缓解持续时间(DoR)和无进展生存期(PFS)。
胰腺癌被称为“癌症之王”,由于早期症状不典型,临床上早期发现率仅为5~7%,是所有癌症中最低的一种。临床就诊时大部分患者已处于中晚期。晚期患者目前仅有数种化疗药物可用,总生存期仅6-9个月。
目前,二线治疗不可切除的局部晚期或转移性胰腺癌的常用化疗药物包括吉西他滨、白蛋白结合型紫杉醇、5-FU等,暂无有效后线治疗方案,针对CLDN18.2阳性的治疗药物则更为有限。
从临床数据看,30.4%的ORR显示出初步的治疗效果,与乐普生物TF ADC药物MRG004A在全人群中的数据接近。但IBI389选择的入选标准为CLDN18.2阳性患者,从这一角度看该药物的临床有效性偏弱。乐普生物MRG004A在TF高表达人群中,MRG004A的ORR高达80%。
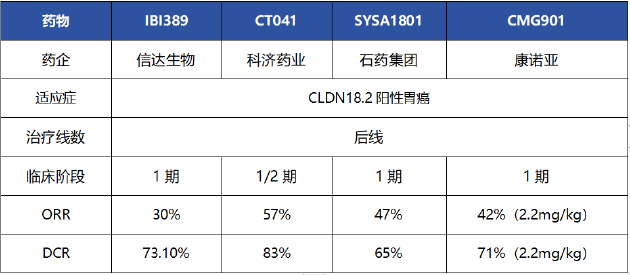
IBI389用于后线治疗胃癌的数据同样表现平平。资料显示,入选标准为治疗失败或不耐受的合格晚期实体瘤患者。截至2024年1月9日,共有114例患者入组。数据显示,在CLDN18.2表达≥10%的患者中,8例患者达到PR,对应ORR为30%,DCR为73.1%。
非头对头对比来看,数据表现弱于同适应症的科济药业CT041、石药集团SYSA1801、康诺亚CMG901。